Farmakoterapijska grupa: antitrombotici, direktni inhibitori faktora Xa. ATC kod: B01AF01.
Mehanizam djelovanja
Rivaroksaban je visokoselektivni, direktni inhibitor faktora Xa, bioraspoloživ nakon oralne primjene. Inhibicijom faktora Xa, prekida se unutrašnji i vanjski put kaskade zgrušavanja krvi, čime se inhibira stvaranje trombina i razvoj tromba. Rivaroksaban ne inhibira trombin (aktivirani faktor II), a nisu pokazani ni učinci na trombocite.
Farmakodinamički učinci
U ljudi je uočena o dozi ovisna inhibicija aktivnosti faktora Xa. Rivaroksaban utiče na protrombinsko vrijeme (PV) ovisno o dozi, pri čemu postoji bliska korelacija s njegovom koncentracijom u plazmi (r vrijednost = 0,98), ako se u testu koristi Neoplastin. S drugim bi se reagensima dobili drugačiji rezultati. Očitanja PV-a treba obaviti u sekundama, jer je INR kalibriran i validiran samo za kumarine i ne može se koristiti za bilo koji drugi antikoagulans.
U kliničkom farmakološkom ispitivanju poništavanja farmakodinamičkog učinka rivaroksabana u zdravih odraslih osoba (n=22), ocijenjeni su učinci pojedinačne doze (50 IU/kg) dva različita tipa koncentrata protrombinskog kompleksa (PCC), PCC-a koji sadrži 3 faktora (faktor II, IX i X), te PCC- a koji sadrži 4 faktora (faktor II, VII, IX i X). PCC koji sadrži 3 faktora smanjio je srednju vrijednost PV-a, koristeći Neoplastin reagens, za otprilike 1,0 sekundu unutar 30 minuta, pri poređenju i sa smanjenjem od otprilike 3,5 sekunde zabilježenim PCC-om koji sadrži 4 faktora. Suprotno tome, PCC koji sadrži 3 faktora imao je veći i brži ukupni učinak na poništavanje promjena u endogenom stvaranju trombina, nego PCC koji sadrži 4 faktora (vidjeti dio 4.9.).
Aktivirano parcijalno tromboplastinsko vrijeme (aPTV) i vrijeme izmjereno Heptestom, također se produžuju ovisno o dozi, no ti se pokazatelji ne preporučuju za procjenu farmakodinamičkih učinaka rivaroksabana. Tokom liječenja rivaroksabanom, nema potrebe za kliničkim rutinskim praćenjem koagulacijskih parametara. Međutim, ako je klinički indicirano, nivoi rivaroksabana mogu se mjeriti kalibriranim kvantitativnim anti-faktor Xa testovima (vidjeti dio 5.2.).
Klinička djelotvornost i sigurnost
AKS
Klinički program za rivaroksaban osmišljen je da bi se pokazala djelotvornost rivaroksabana u sprječavanju kardiovaskularne (KV) smrti, infarkta miokarda (IM) ili moždanog udara u ispitanika s nedavnim akutnim koronarnim sindromom (infarkt miokarda s povišenjem ST spojnice [STEMI], infarkt miokarda bez povišenja ST-spojnice [NSTEMI] ili nestabilna angina pektoris). U pivotalnom dvostruko-slijepom ispitivanju ATLAS AKS 2 TIMI 51, 15.526 pacijenata bilo je nasumično raspodijeljeno u omjeru 1:1:1 u jednu od tri terapijske grupe: rivaroksaban 2,5 mg oralno dvaput na dan, rivarokaban 5 mg oralno dvaput na dan ili placebo dvaput na dan primijenjen istovremeno sa samom ASK-om ili s ASK-om uz dodatak tienopiridina (klopidogrel ili tiklopidin). Pacijenti s AKS, mlađi od 55 godina, morali su imati diabetes mellitus ili prethodni infarkt miokarda. Medijan trajanja liječenja bio je 13 mjeseci i ukupno trajanje liječenja iznosilo je do gotovo 3 godine. 93,2% pacijenata istovremeno je primalo ASK-u uz dodatak tienopiridina, a 6,8% samo ASK. Među pacijentima koji su primali dualnu antitrombocitnu terapiju, 98,8% primalo je klopidogrel, 0,9% primalo je tiklopidin, a 0,3% primalo je prasugrel. Pacijenti su primili prvu dozu rivaroksabana najmanje 24 sata i najviše 7 dana (srednja vrijednost 4,7 dana) nakon prijema u bolnicu, kada bi to bilo moguće nakon stabilizacije AKS-a, uključujući i procedure revaskularizacije i kada bi se parenteralna antikoagulantna terapija obično prekidala.
Oba režima primjene rivaroksabana, 2,5 mg dvaput na dan i 5 mg dvaput na dan, bila su djelotvorna u daljnjem smanjivanju incidencije kardiovaskularnih događaja, u odnosu na standardno antitrombocitno liječenje. Režim od 2,5 mg dvaput na dan smanjio je smrtnost, a dokazi pokazuju da je niža doza imala manji rizik od krvarenja, pa se stoga rivaroksaban od 2,5 mg dvaput na dan, primijenjen istovremeno samo s acetilsalicilnom kiselinom (ASK) ili s ASK-om uz dodatak klopidogrela ili tiklopidina preporučuje za prevenciju aterotrombotskih događaja u odraslih pacijenata nakon akutnog koronarnog sindroma s povišenim srčanim biomarkerima.
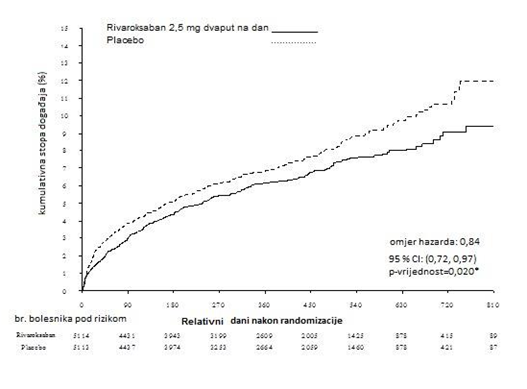
U odnosu na placebo, rivaroksaban je značajno smanjio primarni kompozitni ishod kardiovaskularne smrti, infarkta miokarda ili moždanog udara. Korist je rezultat smanjenja KV smrti i IM i javlja se rano s neprekidnim učinkom kroz cijelo razdoblje liječenja (vidjeti Tabelu 4 i Sliku 1). Prvi sekundarni ishod (svi uzroci smrti, infarkt miokarda ili moždani udar) također je bio značajno smanjen. Dodatna je retrospektivna analiza pokazala nominalno značajno smanjenje stope incidencije tromboze stenta, u poređenju s s placebom (vidjeti Tabelu 4). Stope incidencije glavnog ishoda sigurnosti (nekoronarna arterijska premosnica (ne-CABG) TIMI velika krvarenja) bile su više u pacijenata liječenih rivaroksabanom, nego u pacijenata koji su primali placebo (vidjeti Tabelu 6). Međutim, stope incidencije bile su slične kod rivaroksabana i placeba za komponente krvarenja sa smrtnim ishodom, za hipotenziju koja je zahtijevala liječenje intravenskim inotropnim sredstvima i za hirurške intervencije zbog krvarenja koje ne prestaje.
U Tabeli 5 prikazani su rezultati djelotvornosti u pacijenata, koji su podvrgnuti perkutanoj koronarnoj intervenciji. Rezultati sigurnosti u ovoj podgrupi pacijenata podvrgnutih perkutanoj koronarnoj intervenciji bili su usporedivi s ukupnim rezultatima sigurnosti.
Pacijenti s povišenim biomarkerima (troponin ili CK-MB), koji prethodno nisu imali moždani udar/TIA činili su 80% populacije uključene u ispitivanje. Rezultati ove populacije pacijenata bili su također u skladu s općenitim rezultatima djelotvornosti i sigurnosti.
Tabela 4: Rezultati djelotvornosti iz ispitivanja faze III ATLAS AKS 2 TIMI 51
| Populacija uključena u ispitivanje |
Pacijenti s nedavnim akutnim koronarnim sindromom a) |
| Terapijska doza |
Rivaroksaban 2,5 mg, dvaput na dan, N=5114
n (%)
omjer hazarda (95% CI) p-
vrijednost b) |
Placebo
N=5113 n (%) |
| Kardiovaskularna smrt, infarkt miokarda ili moždani udar |
313 (6,1%)
0,84 (0,72; 0,97) p = 0,020* |
376 (7,4%) |
| Smrtnost od svih uzroka, infarkt miokarda ili moždani udar |
320 (6,3%)
0,83 (0,72; 0,97) p = 0,016* |
386 (7,5%) |
| Kardiovaskularna smrt |
94 (1,8%)
0,66 (0,51; 0,86) p = 0,002** |
143 (2,8%) |
| Smrtnost od svih uzroka |
103 (2,0%)
0,68 (0,53; 0,87) p = 0,002** |
153 (3,0%) |
| Infarkt miokarda |
205 (4,0%)
0,90 (0,75; 1,09) p = 0,270 |
229 (4,5%) |
| Moždani udar |
46 (0,9%)
1,13 (0,74; 1,73) p = 0,562 |
41 (0,8%) |
| Tromboza stenta |
61 (1,2%)
0,70 (0,51; 0,97) p = 0,033** |
87 (1,7%) |
a) modificirana analiza grupe pacijenata planirane za liječenje (analiza ukupne grupe pacijenata planirane za liječenje tromboze stenta)
b) u odnosu na placebo; log-rank p-vrijednost
*statistički superioran
** nominalno značajan
Tabela 5: Rezultati djelotvornosti iz ispitivanja faze III ATLAS AKS 2 TIMI 51, u pacijenata podvrgnutih perkutanoj koronarnoj intervenciji
| Populacija uključena u ispitivanje |
Pacijenti s nedavnim akutnim koronarnim sindromom koji su podvrgnuti perkutanoj koronarnoj intervenciji a) |
| Terapijska doza |
Rivaroksaban 2,5 mg, dvaput na dan, N=3114
n (%)
omjer hazarda (95% CI) p-
vrijednost b) |
Placebo
N=3096
n (%)
|
| Kardiovaskularna smrt, infarkt miokarda ili moždani udar |
153 (4,9%)
0,94 (0,75; 1,17) p = 0,572 |
165 (5,3%) |
| Kardiovaskularna smrt |
24 (0,8%)
0,54 (0,33; 0,89) p = 0,013** |
45 (1,5%) |
| Smrtnost od svih uzroka |
31 (1,0%)
0,64 (0,41, 1,01) p = 0,053 |
49 (1,6%) |
| Infarkt miokarda |
115 (3,7%)
1,03 (0,79; 1,33) p = 0,829 |
113 (3,6%) |
| Moždani udar |
27 (0,9%)
1,30 (0,74; 2,31) p = 0,360 |
21 (0,7%) |
| Tromboza stenta |
47 (1,5%)
0,66 (0,46; 0,95) p = 0,026** |
71 (2,3%) |
a) modificirana analiza grupe pacijenata planirane za liječenje (analiza ukupne grupe pacijenata planirane za liječenje tromboze stenta)
b) u odnosu na placebo; log-rank p-vrijednost
** nominalno značajan
Tabela 6: Rezultati sigurnosti iz ispitivanja faze III ATLAS AKS 2 TIMI 51
| Populacija uključena u ispitivanje |
Pacijenti s nedavnim akutnim koronarnim sindromom a) |
| Terapijska doza |
Rivaroksaban 2,5 mg, dvaput na dan, N=5115
n (%)
omjer hazarda (95% CI) p-
vrijednost b) |
Placebo
N=5125
n (%)
|
| Ne-CABG TIMI veliko krvarenje* |
65 (1,3%)
3,46 (2,08; 5,77) p = <0,001* |
19 (0,4%) |
| Krvarenje sa smrtnim ishodom |
6 (0,1%)
0,67 (0,24; 1,89) p = 0,450 |
9 (0,2%) |
| Simptomatsko intrakranijalno krvarenje |
14 (0,3%)
2,83 (1,02; 7,86) p = 0,037 |
5 (0,1%) |
| Hipotenzija koja zahtijeva liječenje intravenskim inotropnim lijekovima |
3 (0,1%) |
3 (0,1%) |
| Hirurška intervencija zbog krvarenja koje ne prestaje |
7 (0,1%) |
9 (0,2%) |
| Transfuzija 4 ili više jedinica krvi u razdoblju od 48 sati |
19 (0,4%) |
6 (0,1%) |
a) populacija za procjenu sigurnosti, na terapiji
b) u odnosu na placebo; log-rank p-vrijednost
* statistički značajno
Slika 1: Vrijeme do pojave primarnog ishoda djelotvornosti (kardiovaskularna smrt, infarkt miokarda ili moždani udar)
BKA/BPA
Faze III ispitivanja COMPASS (27.395 pacijenata, 78,0% muškaraca, 22,0% žena) pokazala je djelotvornost i sigurnost rivaroksabana u prevenciji kompozitnog ishoda, koji se sastojao od kardiovaskularne smrti, infarkta miokarda, moždanog udara u pacijenata s BKA ili simptomatskim BPA s visokim rizikom od ishemijskih događaja. Pacijenti su bili praćeni tokom medijana od 23 mjeseca, a maksimalno 3,9 godina.
Ispitanici kojima nije bilo potrebno kontinuirano liječenje inhibitorom protonske pumpe bili su randomizirani u grupu koja je primala pantoprazol i grupu koja je primala placebo. Svi su pacijenti potom bili randomizirani u omjeru 1:1:1, u grupu koja je primala rivaroksaban u dozi od 2,5 mg dvaput na dan i ASK u dozi od 100 mg jedanput na dan, grupu koja je primala rivaroksaban u dozi od 5 mg dvaput na dan, i u grupu koja je primala samo ASK u dozi od 100 mg jedanput na dan, te njima odgovarajuće grupe koje su primale placebo.
U pacijenata s BKA, bolest je zahvaćala više krvnih sudova i/ili su ti pacijenti prethodno imali infarkt miokarda. Pacijenti u dobi <65 godina morali su imati aterosklerozom zahvaćena barem dva vaskularna područja ili najmanje dva dodatna faktora rizika za kardiovaskularnu bolest.
Pacijenti s BPA imali su prethodne intervencije, kao što je ugradnja premosnice ili perkutana transluminalna angioplastika ili amputacija ekstremiteta ili stopala zbog bolesti arterija ili intermitentne klaudikacije s omjerom krvnog pritiska na gležnju i nadlaktici <0,90 i/ili značajnu stenozu periferne arterije ili prethodnu revaskularizaciju karotidne arterije ili asimptomatsku stenozu karotidne arterije ≥50%.
Kriteriji isključivanja involvirali su potrebu za dualnom antitrombocitnom ili drugom antitrombocitnom terapijom koja nije ASK ili za oralnom antikoagulantnom terapijom i pacijente s velikim rizikom od krvarenja ili sa zatajenjem srca s ejekcijskom frakcijom <30% ili kategorijom III ili IV prema NYHA (od engl. New York Heart Association) klasifikaciji, ili bilo koji ishemijski, nelakunarni moždani udar unutar 1 mjeseca ili hemoragijski ili lakunarni moždani udar u anamnezi.
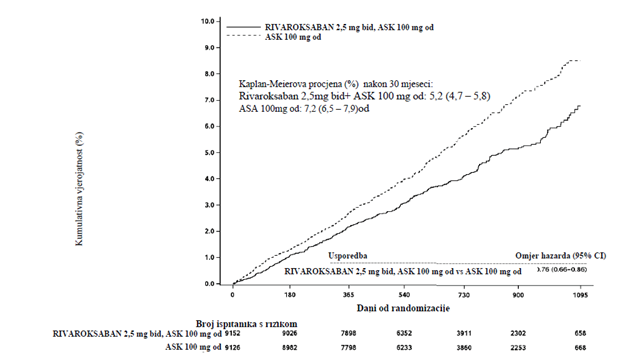
Rivaroksaban u dozi od 2,5 mg dvaput na dan u kombinaciji s ASK-om u dozi od 100 mg jedanput na dan bio je superioran ASK-i u dozi od 100 mg u pogledu smanjenja primarnog kompozitnog ishoda, koji se sastojao od kardiovaskularne smrti, infarkta miokarda i moždanog udara (vidjeti Tabelu 7 i Sliku 2).
Primarni ishod sigurnosti primjene (događaji velikog krvarenja prema modificiranim kriterijima Međunarodnog društva za trombozu i hemostazu, ISTH) bio je značajno povećan u pacijenata liječenih rivaroksabanom u dozi od 2,5 mg dvaput na dan u kombinaciji s ASK-om u dozi od 100 mg jedanput na dan, u poređenju s pacijentima koji su primali ASK u dozi od 100 mg (vidjeti Tabelu 8).
U pogledu primarnog ishoda, djelotvornosti, opažena korist liječenja rivaroksabanom u dozi od 2,5 mg dvaput na dan uz dodatak ASK-e u dozi od 100 mg jedanput na dan u poređenju s ASK-om u dozi od 100 mg jedanput na dan, imala je HR 0,89 (95% CI 0,7-1,1) u pacijenata u dobi od ≥75 godina (incidencija 6,3%, nasuprot 7,0%), te HR=0,70 (95% CI 0,6-0,8) u pacijenata u dobi <75 godina (3,6%, nasuprot 5,0%). Za veliko krvarenje prema modificiranim ISTH kriterijima, opaženo povećanje rizika bilo je HR 2,12 (95% CI 1,5-3,0) u pacijenata u dobi od ≥75 godina (5,2%, nasuprot 2,5%) i HR=1,53 (95% CI 1,2-1,9) u pacijenata u dobi <75 godina (2,6%, nasuprot 1,7%).
Primjena pantoprazola u dozi od 40 mg jedanput na dan, kao dodatka liječenju ispitivanim antitrombotikom, u pacijenata bez kliničke potrebe za inhibitorima protonske pumpe, nije pokazala korist u prevenciji događaja vezanih uz gornji dio gastrointestinalnog sistema (tj. kompozita krvarenja u gornjem dijelu gastrointestinalnog sistema, ulceracije gornjeg dijela gastrointestinalnog sistema ili opstrukcije ili perforacije gornjeg dijela gastrointestinalnog sistema); stopa incidencije događaja vezanih uz gornji dio gastrointestinalnog sistema bila je 0,39/100 pacijent-godina u grupi koja je primala pantoprazol 40 mg jedanput na dan, te 0,44/100 pacijent-godina u grupi koja je primala placebo jedanput na dan.
Tabela 7: Rezultati djelotvornosti iz ispitivanja faze III COMPASS
| Ispitivana populacija |
Pacijenti s BKA/BPAa) |
| Terapijska doza |
Rivaroksaban 2,5 mg dvaput na dan u kombinaciji s ASK-om 100 mg jedanput na dan
N=9152 |
ASK 100 mg
jedanput na dan
N=9126 |
|
| |
Pacijenti s događajima |
KM% |
Pacijenti s događajima |
KM% |
HR
(95% CI) |
p-
vrijednost b) |
| |
| Moždani udar, infarkt miokarda ili kardiovaskularna smrt |
379 (4,1%) |
5,20% |
496 (5,4%) |
7,17% |
0,76
(0,66; 0,86) |
p =
0,00004* |
- Moždani udar
|
83 (0,9%) |
1,17% |
142 (1,6%) |
2,23% |
0,58
(0,44; 0,76) |
p =
0,00006 |
- Infarkt miokarda
|
178 (1,9%) |
2,46% |
205 (2,2%) |
2,94% |
0,86
(0,70; 1,05) |
p =
0,14458 |
- Kardiovaskularna smrt
|
160 (1,7%) |
2,19% |
203 (2,2%) |
2,88% |
0,78
(0,64; 0,96) |
p =
0,02053 |
| |
| Smrtnost od svih uzroka |
313 (3,4%) |
4,50% |
378 (4,1%) |
5,57% |
0,82
(0,71; 0,96) |
|
| Akutna ishemija ekstremiteta |
22 (0,2%) |
0,27% |
40 (0,4%) |
0,60% |
0,55
(0,32;0,92) |
|
a) analiza grupe pacijenata planirane za liječenje, primarne analize
b) nasuprot ASK 100 mg; log-rank p-vrijednost
* Smanjenje primarnog ishoda djelotvornosti bilo je statistički superiorno.
CI: raspon pouzdanosti; KM %: Kaplan-Meierova procjene rizika kumulativne incidencije izračunatog nakon 900 dana
Tabela 8: Rezultati sigurnosti primjene iz ispitivanja faze III COMPASS
| Ispitivana populacija |
Pacijenti s BKA/BPA a) |
| Terapijska doza |
Rivaroksaban
2,5 mg dvaput na dan u kombinaciji s ASK-om 100 mg jedanput na dan,
N=9152
n (kum. rizik %) |
ASK 100 mg jedanput na dan
N=9126
n (kum. rizik %)
|
Omjer hazarda (95% CI)
p-vrijednost b)
|
| Veliko krvarenje prema modificiranim kriterijima ISTH-a |
288 (3,9%) |
170 (2,5%) |
1,70 (1,40; 2,05)
p <0,00001 |
- Događaj krvarenja sa smrtnim ishodom
|
15 (0,2%) |
10 (0,2%) |
1,49 (0,67; 3,33)
p = 0,32164 |
- Simptomatsko krvarenje u kritični organ (bez smrtnog ishoda)
|
63 (0,9%) |
49 (0,7%) |
1,28 (0,88; 1,86)
p = 0,19679 |
- Krvarenje na mjestu hirurške intervencije, koje je zahtijevalo ponovnu operaciju (bez smrtnog ishoda, ne u kritični organ)
|
10 (0,1%) |
8 (0,1%) |
1,24 (0,49; 3,14)
p = 0,65119 |
- Krvarenje koje je dovelo do hospitalizacije (bez smrtnog ishoda, ne u kritični organ, nije zahtijevalo ponovnu operaciju)
|
208 (2,9%) |
109 (1,6%) |
1,91 (1,51; 2,41)
p <0,00001 |
- Uz noćenje u bolnici
|
172 (2,3%) |
90 (1,3%) |
1,91 (1,48; 2,46)
p <0,00001 |
- Bez noćenja u bolnici
|
36 (0,5%) |
21 (0,3%) |
1,70 (0,99; 2,92)
p = 0,04983 |
| Veliko gastrointestinalno krvarenje |
140 (2,0%) |
65 (1,1%) |
2,15 (1,60; 2,89)
p <0,00001 |
| Veliko intrakranijalno krvarenje |
28 (0,4%) |
24 (0,3%) |
1,16 (0,67; 2,00)
p = 0,59858 |
a) analiza grupe pacijenata planirane za liječenje, primarne analize
b) nasuprot ASK 100 mg; log-rank p-vrijednost
CI: raspon pouzdanosti; kum. rizik: rizik kumulativne incidencije (Kaplan-Meierova procjena) nakon 30 mjeseci; ISTH: Međunarodno društvo za trombozu i hemostazu (engl. International Society on Thrombosis and Haemostasis)
Slika 2: Vrijeme do prve pojave primarnog ishoda djelotvornosti (moždani udar, infarkt miokarda, kardiovaskularna smrt) u ispitivanju COMPASS
bid: dvaput na dan; od: jedanput na dan; CI: raspon pouzdanosti
Pacijenti u kojih je nedavno provedena procedura revaskularizacije donjeg ekstremiteta zbog simptomatske BPA
U pivotalnom dvostruko-slijepom ispitivanju faze III pod nazivom VOYAGER PAD, 6.564 pacijenata u kojih je nedavno uspješno provedena procedura revaskularizacije donjeg ekstremiteta (hirurškim ili endovaskularnim zahvatom, uključujući i kombiniranu proceduru) zbog simptomatske BPA, randomizirano je u omjeru 1:1 u jednu od dvije grupe koje su primale antitrombotsku terapiju: grupu koja je primala rivaroksaban od 2,5 mg dvaput na dan u kombinaciji s ASK-om u dozi od 100 mg jedanput na dan ili grupu koja je primala ASK-u u dozi od 100 mg jedanput na dan. Pacijentima je bilo dopušteno dodatno primati standardnu dozu klopidogrela jedanput na dan, najduže 6 mjeseci. Cilj ispitivanja bio je dokazati djelotvornost i sigurnost rivaroksabana, uz dodatak ASK-e, u prevenciji infarkta miokarda, ishemijskog moždanog udara, KV smrti, akutne ishemije ekstremiteta ili velike amputacije zbog vaskularne etiologije u pacijenata u kojih je nedavno uspješno provedena procedura revaskularizacije donjeg ekstremiteta zbog simptomatske BPA. Bili su uključeni pacijenti u dobi od ≥50 godina, s dokumentiranom umjerenom do teškom simptomatskom aterosklerotičnom BPA donjeg ekstremiteta, što je dokazano na svim sljedećim nivoima: kliničkom (tj. funkcionalna ograničenja), anatomskom (tj. slikovni dokazi BPA distalno od vanjske ilijačne arterije) i hemodinamičkom (indeks gležanj-nadlaktica [engl. Ankle-Brachial Indeks - ABI] ≤0,80 ili indeks palac-nadlaktica [engl. Toe-Brachial Indeks - TBI] ≤0,60 u pacijenata bez prethodne revaskularizacije ekstremiteta u anamnezi ili ABI ≤0,85 ili TBI ≤0,65 u pacijenata s prethodnom revaskularizacijom u anamnezi). Bili su isključeni pacijenti kojima je bila potrebna dualna antitrombocitna terapija >6 mjeseci ili bilo koja dodatna antitrombocitna terapija osim ASK-e i klopidogrela, ili oralna antikoagulantna terapija, kao i pacijenti s anamnezom intrakranijalnog krvarenja, moždanog udara ili TIA-e ili pacijenti s eGFR <15 ml/min.
Srednja vrijednost trajanja praćenja bila je 24 mjeseca, a najduže praćenje trajalo je 4,1 godinu. Srednja vrijednost dobi uključenih pacijenata bila je 67 godina, a 17% populacije pacijenata bilo je u dobi od >75 godina. Medijan vremena od indeksne procedure revaskularizacije do početka ispitivanog liječenja iznosio je 5 dana u cjelokupnoj populaciji (6 dana nakon hirurške i 4 dana nakon endovaskularne revaskularizacije, uključujući i kombinirane procedure). Ukupno je 53,0% pacijenata primalo kratkotrajnu osnovnu terapiju klopidogrelom, u medijanu trajanja od 31 dan. Prema planu ispitivanja, ispitivano liječenje moglo je započeti čim je to bilo moguće, ali najkasnije 10 dana nakon uspješne procedure revaskularizacije, kao kriterija za uključenje, i nakon uspostavljene hemostaze.
Rivaroksaban u dozi od 2,5 mg dvaput na dan, u kombinaciji s ASK-om od 100 mg jedanput na dan, bio je superioran u poređenju s s primjenom samo ASK-e u smanjenju primarnog kompozitnog ishoda, koji se sastojao od infarkta miokarda, ishemijskog moždanog udara, KV smrti, akutne ishemije ekstremiteta i velike amputacije zbog vaskularne etiologije (vidjeti Tabelu 9). Događaji TIMI velikog krvarenja, kao primarni ishod sigurnosti, bili su češći u pacijenata liječenih rivaroksabanom i ASK-om, bez povećanja smrtonosnog ili intrakranijalnog krvarenja (vidjeti Tabelu 10).
Sekundarni ishodi djelotvornosti bili su ispitani prema unaprijed određenom, hijerarhijskom redoslijedu (vidjeti Tabelu 9).
Tabela 9: Rezultati djelotvornosti iz ispitivanja faze III VOYAGER PAD
| Ispitivana populacija |
Pacijenti u kojih je nedavno provedena procedura revaskularizacije donjeg ekstremiteta zbog simptomatskog BPA a) |
| Terapijska doza |
Rivaroksaban 2,5 mg dvaput na dan u kombinaciji s ASK-om 100 mg jedanput na dan
N=3286
n (kum. rizik %) c) |
ASA 100 mg jedanput na dan
N=3278
n (kum. rizik %) c)
|
omjer hazarda (95% CI) d) |
| Primarni ishod djelotvornosti b) |
508 (15,5%) |
584 (17,8%) |
0,85 (0,76;0,96)
p = 0,0043 e)*
|
- Infarkt miokarda
|
131 (4,0%) |
148 (4,5%) |
0,88 (0,70;1,12) |
- Ishemijski moždani udar
|
71 (2,2%) |
82 (2,5%) |
0,87 (0,63;1,19) |
- KV smrt
|
199 (6,1%) |
174 (5,3%) |
1,14 (0,93;1,40) |
- Akutna ishemija ekstremiteta f)
|
155 (4,7%) |
227 (6,9%) |
0,67 (0,55;0,82) |
- Velika amputacija zbog vaskularne etiologije
|
103 (3,1%) |
115 (3,5%) |
0,89 (0,68;1,16) |
| Sekundarni ishod djelotvornosti |
|
|
|
| Neplanirana indeksna revaskularizacija zbog recidivirajuće ishemije ekstremiteta |
584 (17,8%) |
655 (20,0%) |
0,88 (0,79;0,99)
p = 0,0140 e)* |
| Hospitalizacija zbog koronarnog ili perifernog uzroka (bilo koji donji ekstremitet) trombotičke naravi |
262 (8,0%) |
356 (10,9%) |
0,72 (0,62;0,85)
p <0,0001 e)* |
| Smrtnost od svih uzroka |
321 (9,8%) |
297 (9,1%) |
1,08 (0,92;1,27) |
| VTE događaji |
25 (0,8%) |
41 (1,3%) |
0,61 (0,37;1,00)
|
a) Skup podataka za analizu populacije planirane za liječenje, primarne analize; prema prosudbi ICAC-a
b) Kompozitni ishod sastavljen je od infarkta miokarda, ishemijskog moždanog udara, KV smrti (KV smrt i nepoznati uzrok smrti), akutne ishemije ekstremiteta i velike amputacije zbog vaskularne etiologije.
c) U obzir se uzima samo prva pojava ishodnog događaja, uključenog u analizu unutar opsega podataka za jednog ispitanika.
d) HR (95% CI) se temelji na Coxovom modelu proporcionalnih hazarda stratificiranih prema vrsti procedure i primjeni klopidogrela s liječenjem kao jedinom kovarijatom.
e) Jednostrana p-vrijednost temelji se na log-rank testu, stratificiranom prema vrsti procedure i primjeni klopidogrela s liječenjem kao faktorom.
f) Akutna ishemija ekstremiteta definirana je kao iznenadno značajno pogoršanje perfuzije ekstremiteta, bilo uz novi deficit pulsa ili uz potrebnu terapijsku intervenciju (tj. trombolizu ili trombektomiju ili hitnu revaskularizaciju) koja je dovela do hospitalizacije.
* Smanjenje ishoda djelotvornosti bilo je statistički superiorno.
CI: raspon pouzdanosti; KV: kardiovaskularni, ICAC (engl. Independent Clinical Adjudication Committee): Nezavisno povjerenstvo za kliničku procjenu
Tabela 10: Rezultati sigurnosti u ispitivanju faze III VOYAGER PAD
| Ispitivana populacija |
Pacijenti u kojih je nedavno provedena procedura revaskularizacije donjeg ekstremiteta zbog simptomatskog BPA a) |
| Terapijska doza |
Rivaroksaban 2,5 mg dvaput na dan u kombinaciji s ASK-om 100 mg jedanput na dan
N=3256
n (kum. rizik %) b) |
ASK 100 mg
jedanput na dan
N=3248
n (kum. rizik %) b)
|
omjer hazarda (95% CI) c)
p-vrijednost d)
|
TIMI veliko krvarenje
(CABG/ne-CABG) |
62 (1,9%) |
44 (1,4%) |
1,43 (0,97;2,10)
p = 0,0695 |
- Krvarenje sa smrtnim ishodom
|
6 (0,2%) |
6 (0,2%) |
1,02 (0,33;3,15) |
- Intrakranijalno krvarenje
|
13 (0,4%) |
17 (0,5%) |
0,78 (0,38;1,61) |
- Manifestno krvarenje povezano sa sniženjem
- Hb ≥5 g/dl / Hct ≥15%
|
46 (1,4%) |
24 (0,7%) |
1,94 (1,18;3,17) |
| ISTH veliko krvarenje |
140 (4,3%) |
100 (3,1%) |
1,42 (1,10;1,84)
p = 0,0068 |
- Krvarenje sa smrtnim ishodom
|
6 (0,2%) |
8 (0,2%) |
0,76 (0,26;2,19) |
- Krvarenje u kritični organ bez smrtnog ishoda
|
29 (0,9%) |
26 (0,8%) |
1,14 (0,67;1,93) |
| ISTH klinički značajno krvarenje. koje nije veliko |
246 (7,6%) |
139 (4,3%) |
1,81 (1,47;2,23) |
a) Skup podataka za analizu sigurnosti (svi randomizirani ispitanici s najmanje jednom dozom ispitivanog lijeka), ICAC (engl. Independent Clinical Adjudication Committee): Neovisno povjerenstvo za kliničku procjenu
b) n = broj ispitanika s događajem, N = broj ispitanika pod rizikom, % = 100 * n/N, n/100b-god = omjer broja ispitanika s incidentnim događajima/kumulativno vrijeme pod rizikom
c) HR (95% CI) se temelji na Coxovom modelu proporcionalnih hazarda, stratificiranih prema vrsti postupka i primjeni klopidogrela s liječenjem kao jedinom kovarijatom.
d) Dvostrana p-vrijednost temelji se na log-rank testu, stratificiranom prema vrsti postupka i primjeni klopidogrela s liječenjem kao faktorom.
Pacijenti s BKA koji imaju zatajenje srca
COMMANDER HF ispitivanje uključivalo je 5.022 pacijenata sa zatajenjem srca i značajnom bolesti koronarnih arterija (BKA) nakon hospitalizacije radi dekompenzacije srčanog zatajenja, koji su randomizirani u jednu od dvije grupe: rivaroksaban 2,5 mg dvaput na dan (N=2507) ili placebo (N=2515). Ukupni medijan trajanja liječenja bio je 504 dana. Pacijenti su morali imati simptomatsko zatajenje srca najmanje 3 mjeseca i ejekcijsku frakciju lijeve komore (engl. Left Ventricular Ejection Fraction - LVEF) ≤40% unutar jedne godine od uključenja. Medijan početnih vrijednosti ejekcijske frakcije bio je 34% (interkvartilni raspon 28%-38%), a 53% ispitanika bili su kategorije III ili IV, prema NYHA klasifikaciji.
Primarna analiza djelotvornosti (tj. kompozitni ishod koji obuhvaća smrtnost od svih uzroka, infarkt miokarda ili moždani udar) nije pokazala statistički značajnu razliku između grupe koja je primala rivaroksaban 2,5 mg dvaput na dan i grupe koja je primala placebo s HR=0,94 (95% CI 0,84 – 1,05), p=0,270. Za smrtnost od svih uzroka, nije bilo razlike između rivaroksabana i placeba u broju događaja (stopa događaja na 100 pacijent-godina; 11,41 nasuprot 11,63, HR: 0,98; 95% CI: 0,87 – 1,10; p=0,743). Stopa događaja za infarkt miokarda na 100 pacijent-godina bila je 2,08 nasuprot 2,52 (HR 0,83; 95% CI: 0,63 do 1,08; p=0,165), a za moždani udar stopa događaja na 100 pacijent-godina bila je 1,08 nasuprot 1,62 (HR: 0,66; 95% CI: 0,47 do 0,95; p=0,023). Glavni ishod sigurnosti (tj. kompozitni ishod koji obuhvaća smrtonosna krvarenja ili krvarenja u kritični prostor s mogućnosti trajnog invaliditeta) javio se u 18 (0,7%) pacijenata u grupi koja je primala rivaroksaban 2,5 mg dvaput na dan, te u 23 (0,9%) pacijenta u grupi koja je primala placebo (HR=0,80; 95% CI 0,43 – 1,49; p=0,484). Veliko krvarenje, prema kriterijima ISTH-a, značajno je povećano u grupi s rivaroksabanom, u odnosu na placebo grupu (stopa događaja na 100 pacijent-godina: 2,04 nasuprot 1,21, HR 1,68; 95% CI: 1,18 – 2,39; p=0,003).
U pacijenata s blagim i umjerenim zatajenjem srca, učinci liječenja za podgrupe iz ispitivanja COMPASS bili su slični onima iz cjelokupne ispitivane populacije (vidjeti dio BKA/BPA).
Pacijenti s visokorizičnim trostruko pozitivnim antifosfolipidnim sindromom
U randomiziranom, multicentričnom, otvorenom ispitivanju, sponzoriranom od strane ispitivača, sa slijepom procjenom mjera ishoda, rivaroksaban je uspoređen s varfarinom u pacijenata s anamnezom tromboze, kojima je dijagnosticiran antifosfolipidni sindrom, i koji imaju visok rizik od tromboembolijskih događaja (pozitivni na sva tri testa za antifosfolipidni sindrom: lupus antikoagulans, antikardiolipinska antitijela i anti-beta 2-glikoprotein I antitijela). Ispitivanje je nakon uključivanja 120 pacijenata završeno prijevremeno, zbog velikog broja događaja u grupi koja je primala rivaroksaban. Srednja vrijednost perioda praćenja iznosila je 569 dana. U grupu koja je primala 20 mg rivaroksabana randomizirano je 59 ispitanika (15 mg u pacijenata s klirensom kreatinina <50 ml/min), a u grupu koja je primala varfarin 61 pacijent (INR 2,0-3,0). Tromboembolijski događaji pojavili su se u 12% pacijenata randomiziranih u grupu koja je primala rivaroksaban (4 ishemijska moždana udara i 3 infarkta miokarda). U pacijenata randomiziranih u grupu koja je primala varfarin, nije bilo prijavljenih događaja. U 4 pacijenata (7%) iz grupe koja je primala rivaroksaban i 2 pacijenata (3%) iz grupe koja je primala varfarin, došlo je do velikog krvarenja.
Pedijatrijska populacija
Evropska agencija za lijekove je izuzela obavezu podnošenja rezultata ispitivanja rivaroksabana u svim podgrupama pedijatrijske populacije u prevenciji tromboembolijskih događaja. (vidjeti dio 4.2. za informacije o pedijatrijskoj primjeni).